第3号 特集:鉄の惑星・地球 Earth, the Iron Planet 铁之星球——地球
鉄と生命──鉄はなぜ生命に選ばれたのか
高萩航+北台紀夫【東京大学, 海洋研究開発機構】
Role of Iron in Life: A ReviewWataru Takahagi+Norio Kitadai【The University of Tokyo, JAMSTEC】
铁与生命——铁为什么选择了生命
──舌の重さが象一頭分に匹敵するという巨大なシロナガスクジラから虫メガネでも見えない微生物まで、DNAの複製には鉄が関与している。全生物に共通した酵素反応である。見た目も大きさも全く異なる生物が同じような機能を共有しているのだ。生物は確かに繋がっている。そうした地球における鉄と生命との関わりは40億年以上かけて試行錯誤を繰り返してきたものだ。ここでは最新の成果を踏まえ、地球生命誕生前夜から現在まで、生命システムにおける鉄の働きについて概観する。(特集担当:伊藤孝)
[2021.10.4 UPDATE]
Iron is the fourth most abundant element on Earth. All life on Earth, including microorganisms, deep-sea organisms, plants, and humans, uses iron as the core of its life system. Earth is called the “planet of water,” but it is also the “planet of iron.” In the case of humans, the six elements of CHONPS alone account for 98.2% of our body, but they are not sufficient to maintain the life system; the function of iron and other metallic elements is indispensable. So why did our life choose iron? How was iron chosen? The relationship between life and iron began about 4 billion years ago, the Hadean era. By a powerful reducing agent or electron donor, ferrous or metallic iron likely acted as a catalyst for synthesizing the building blocks of life. Iron has since been naturally incorporated into life systems and used as the center of metalloenzymes and electron transfer systems. Iron readily forms coordination bonds with nitrogen, oxygen, and sulfur in various biomolecules, producing many coordination compounds that are essential for life. For life living on Earth, iron is a “convenient” element. Here we describe the chemical properties of iron, the relationship between life and iron, the role of iron in the origin and evolution of life, and why life on Earth chose iron as an inextricable partner.
鉄を海に撒いてみた研究者がいる。
南極海などには、植物プランクトンの成長に必要な栄養塩が豊富であるにもかかわらず、その成長がみられない高栄養塩-低クロロフィル(High Nutrient Low Chlorophyll; HNLC)海域が存在し、南極パラドックスと呼称されてきた。John Martin博士らが同じくHNLC海域とされる北太平洋亜寒帯域の鉄濃度を測定してみると、ほかの海域よりも著しく濃度が低いことがわかり、HNLC海域における植物プランクトンの成長は海洋中の鉄の欠乏によって制限されていると提案した★1。また、氷河期には陸上からの鉄供給量が多く海洋の生物活動による二酸化炭素のとり込みが活発であると推定されることから、海洋への鉄の供給量に依存して大気の二酸化炭素濃度が変動し氷河期-間氷期のサイクルに影響すると考え、「鉄仮説」として提案した★2。Martin博士らはこの仮説を確かめるべく、HNLC海域とされる南極海、北太平洋亜寒帯域、赤道海域の海水を採取して鉄を加える実験を行った★3、4。その結果、過剰な硝酸塩などの栄養塩と二酸化炭素が消費され、植物プランクトンが増殖することが確認された。
また、彼らは赤道直下の太平洋上64km2という広大な海域に鉄を撒いた★5(ちなみに、この研究の結果を待たずにMartin博士は亡くなってしまったが、Martin博士を筆頭著者としてNature誌に論文が発表された)。その結果、予想通り鉄に餓えていた海域の植物プランクトンが急激に増殖した(植物のバイオマスは2倍に、クロロフィルは3倍、そして一次生産量は4倍まで増加した)。
海に鉄を散布する実験はその後何度か実行された。例えば、津田博士を筆頭とする日本人研究グループはSEEDSという一連のプロジェクトで北太平洋亜寒帯域において鉄散布実験を行い、栄養塩と溶存二酸化炭素の減少に伴う植物プランクトンの増殖を確認した★6、7。氷河期-間氷期サイクルには鉄のみが関わっているわけではないが、海洋への鉄の供給量が植物プランクトンの成長を制限しているという仮説は立証された。
このように、生命は鉄を求めて、鉄を使って生きている。鉄は生命が生きる上で都合がよく、また必須元素のひとつである。生命がこれほどまでに鉄を求める理由はどこにあるのだろうか。
無数にある金属元素のうち何故鉄は生物によって必須元素として選ばれたのか
生命は基本骨格であるCHONPSに加え、Mn、Fe、Co、Ni、Cu、Znなどの遷移金属元素(とくにdブロック元素)☆1を必須元素としている。ほかにも、Moのように、地球上の存在量が少ないにも関わらず一部の生物にとっては必須な元素も存在する。ヒトには28種類の必須元素が確認されており、鉄は遷移金属元素の中では唯一主要元素に分類される。
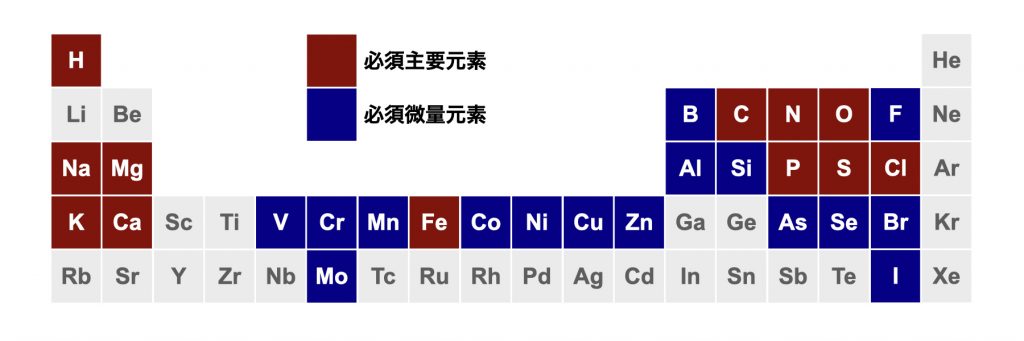
図1──第5周期までの元素周期表とヒトの主要・微量元素の分布
図2および表1に生体中の元素濃度を、海洋中・地殻中の元素濃度と共に示す。MnからZnは金属酵素によく見られる元素であり、生体内では海水中と比べて2~4桁ほど高い濃度で存在するが、中でもFeやZnの濃度は際立って高い。多いと言っても、60kgの成人にわずか3.6gの鉄が含まれている程度である。この多いようで少ない鉄が、生命機能を維持する上で重要な働きを担っている。
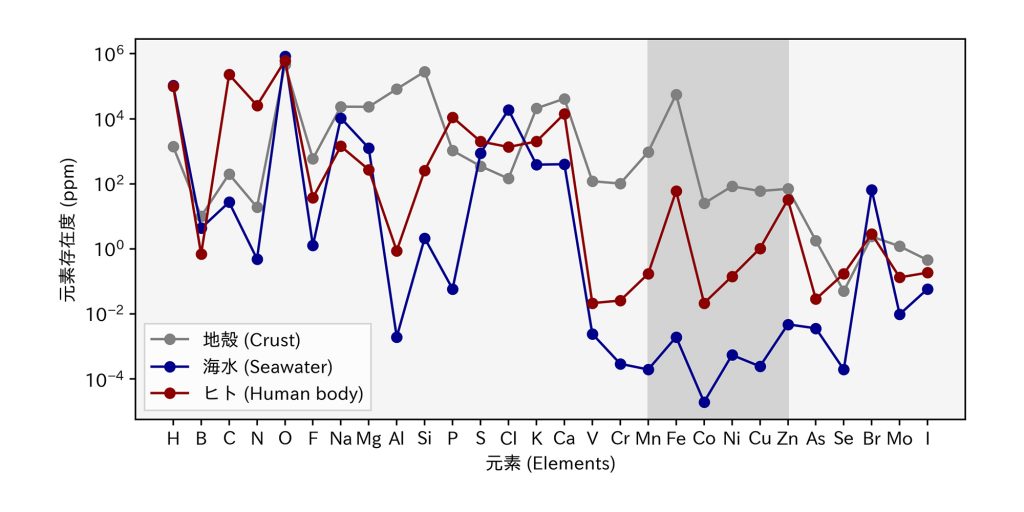
図2──元素の地殻、海水、人体それぞれの含有量の比較(単位:ppm)。濃いグレーの帯は金属酵素としてよく使われる元素であるMn、Fe、Co、Ni、Cu、Znである
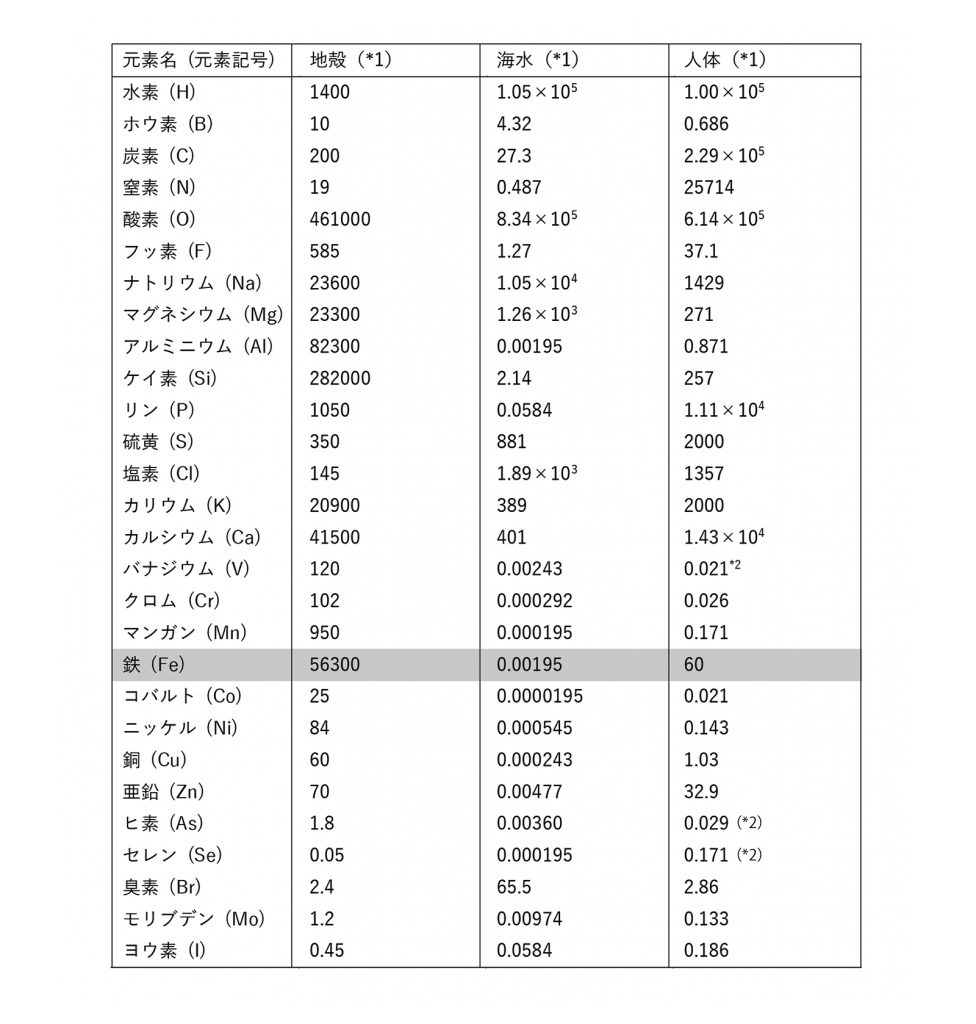
表1──地殻、海水、人体中の金属元素含有量の比較(単位:ppm)
次に、鉄の化学的な性質について述べ、なぜ鉄が生命にとって重要な元素なのかを解説する。鉄の原子番号は26なので、陽子の数は26個、そして電子の数も26個である。鉄の26個の電子を電子軌道 (オービタル)に配置したときの電子配置は1s22s22p63s23p64s23d6であり、4s軌道はやや不安定で4s軌道の2個の電子を取り去った2価のイオン(Fe2+)になりやすい。また、3d軌道はdxy、dyz、dzx、dx2-y2、dz2という5つの軌道が存在(5重に縮退)するが、鉄の3d6の電子からさらに1つの電子を取り去り5つのd軌道にひとつずつ電子が入った3価のイオン(Fe3+)にもなりやすい。鉄はさまざまな酸化状態(Fe2–からFe6+)をとることができるが、モノオキシゲナーゼが酸素分子を基質に取り込む際にFe4+やFe5+を利用する以外は、生体内では基本的にFe2+とFe3+が用いられる。生命は、このFe2+とFe3+をうまく利用することで酸化還元反応などのさまざまな反応を駆動する。Fe2+とFe3+はタンパク質の中でほぼ同じ錯構造をとることができ、またタンパク質のFe2+を含む状態とFe3+を含む状態のエネルギー差も小さいことが功を奏し、生命の必須元素として選ばれた。鉄以外の遷移金属ではこのような特徴は発揮できない。初期地球の海水中に鉄が多かった (< 2mM)ことも考慮すると、鉄が選ばれたのは必然であった。例えば生体内で電子伝達を担う鉄硫黄タンパク質であるフェレドキシンには酸化型(Fdox)と還元型(Fdred)が存在するが、電子を受け渡すたびにタンパク質の構造が変わってしまったら付随する反応を阻害しかねない。またフェレドキシンはFe2+/Fe3+の酸化還元電位を約–0.5VSHE(versus the Standard Hydrogen Electrode; 対標準水素電極電位)から約+0.6VSHEまで柔軟に変化させることができ、鉄をうまく利用して酸化還元電位を生化学的に最適な範囲に調節している。もし鉄のような便利な元素がなければ生物は生命活動を維持するための化学反応を効率的に引き起こすことができず、ここまで進化できなかったかもしれない。
生命が生まれてすぐの時代の地球大気には酸素がほぼ存在しなかったが、その後、シアノバクテリアの登場によって酸素が豊富になった。硫黄や酸素との結合が強すぎると化学反応は止まってしまうし、弱すぎると反応に寄与しない。AlやSiは酸化物として、CuやZnは硫化物として安定すぎる。酸化物生成のエンタルピーと、硫化物生成のエンタルピーの差を以下に示す(表2、図3)。硫黄とも酸素とも適度な結合を作れる鉄は、地球の環境で生きていくうえではたいへん「都合の良い」元素であると言える。
■本章のまとめ
■鉄は遷移金属元素の中では唯一主要元素に分類される。
■60 kgのヒトに約3.6 gほど含まれる鉄は、生体内で起こるさまざまな反応を担う。
■鉄の酸化数によって鉄を含むタンパク質中の構造変化が起こりにくいことや、硫黄や酸素と適度な結合をつくれることから、鉄は生物によって必須元素として選ばれた。
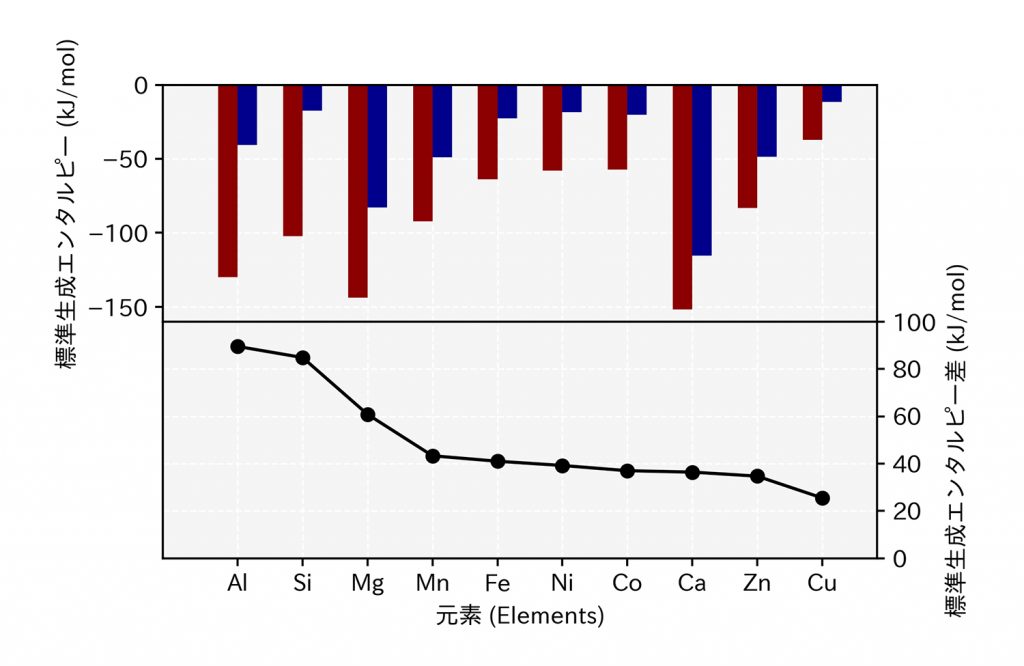
図3──硫化物と酸化物の標準生成エンタルピー差(表2に基づく)。赤: 酸化物の標準生成エンタルピー、青: 硫化物の標準生成エンタルピー、折れ線: 酸化物と硫化物の標準生成エンタルピーの差
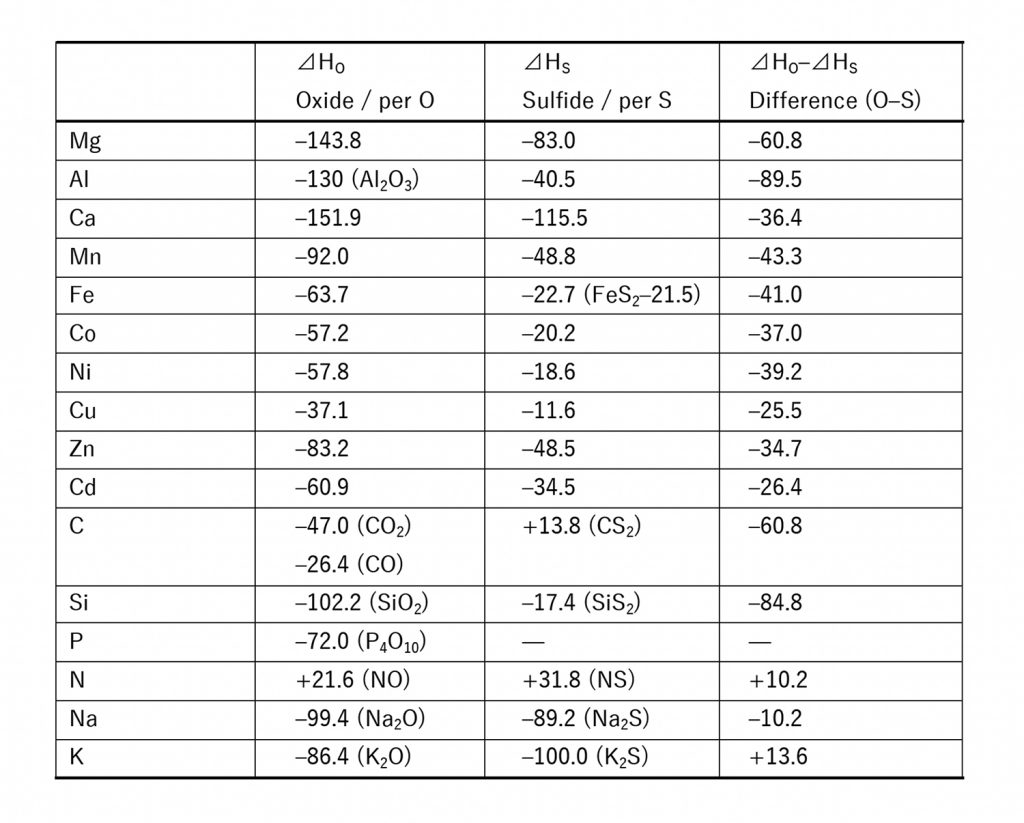
表2──25˚Cにおける酸化物生成と硫化物生成のエンタルピー (kcal)
鉄は細胞のなかでどのような働きを担っているのか
ヒトを構成する元素のうち、CHONPSの6元素の総量だけで98.2 %を占めるが、これだけでは生命活動を維持できない。鉄をはじめとする金属元素の働きが必要である。生体必須金属元素のうち、化学的な性質や生体内での役割に応じて、4つのグループに分類される (表2)。

表2──生体必須金属元素の働き
生命は代謝によって生命活動を維持しており、代謝は酸化還元反応を含むさまざまな反応の組合せから成り立っている。酸化還元反応には電子の授受が必要であるが、鉄は硫黄とともにFe-Sクラスターを形成し、電子伝達系として最終電子受容体である酸素への電子の輸送などを行う。また鉄はさまざまな酸化還元反応を触媒する酵素の活性中心として機能している。例えば、鉄はリボヌクレオチドレダクターゼ内でリボヌクレオチドの還元を触媒し、DNA複製に必要な4つのデオキシリボヌクレオチドを生成している★9。この酵素反応は全生物共通である★10。そのほかにも、ヘモグロビンのヘムとしての酸素の運搬、ミトコンドリア内のチトクロムでのエネルギー生成などにも鉄が必須である。鉄はまさしく生命活動に必要な必須な元素であることがわかる。
■本章のまとめ
■ヒトを構成するCHONPSの主要6元素だけで総量の98.2 %を占めるが、これだけでは生命活動を維持できず、鉄をはじめとする金属元素の働きが必要である。
■鉄の酸化状態は多様であり、酸化還元、酸素運搬などさまざまな反応を担うことができる。
鉄は生命の起源、生物の進化にどのような役割を担ってきたのか
鉄と生命との関わりはいまから40億年以上前の冥王代(Hadean eon)にまで遡る。冥王代は地球誕生から40億年前までの地質時代を指しており、地球の形成、海の形成、生命の誕生が起こった。地質記録がほとんど存在せず、実態が闇に包まれていることからHades(ギリシャ神話の冥界神)にちなんで名付けられた。ここでは、冥王代の生命誕生へ果たした鉄の役割について、関連する研究成果を紹介する。
現在広く受け入れられているシナリオの一つに、生命の化学進化説がある。Aleksandr I. OparinやJohn B. S. Haldaneが提案したこのシナリオによると、生命の発生は初期地球上のさまざまな無機・有機化学プロセスの集積から達成された★11。1953年に当時23歳の大学院生だったStanley Millerらは水素やメタン、アンモニアを含む気体に電気放電するなどしてアミノ酸の合成に成功した★12。初期地球の大気にはメタンやアンモニアはほとんど存在せず二酸化炭素や窒素が主であったことから、初期地球の大気化学反応とは関係ないものの、無機物から生命のもとの合成に成功した画期的な実験であった。また、深海熱水噴出孔を想定した環境でアミノ酸やペプチド、あるいはRNAやDNAなど、生命のもととなる物質の合成や挙動が多く調べられた。
このような過程をしばしばPrebiotic Chemistryというが、この過程には鉄が深く関わっているようである。Prebiotic Chemistryのなかでも、とりわけ独立栄養シナリオと呼ばれる二酸化炭素を炭素源とした自発的な化学反応の連鎖が生命の誕生に寄与したという仮説★13において、鉄は重要な登場人物となる。冥王代から太古代にかけて大気中には酸素が乏しく二酸化炭素が豊富であり、それが海に溶け込むことで海は弱酸性を示していた★14、15。弱酸性の海水は遷移金属元素のリザーバーとなり、鉄などの元素を現在の海水よりも多く溶かし込んでおり★16、その鉄は2価のイオン(Fe2+)として存在していた。初期の熱水噴出孔からは硫化物イオンが噴出し、海水中のFe2+などの遷移金属イオンと反応することで、さまざまな硫化金属沈殿物を生じただろう。初期地球の、まだ酸素がなく還元的な環境であれば金属鉄Fe0も利用できたとされる。このような海水中のFe2+イオンや沈殿したFeSなどの金属硫化物はさまざまな生命前駆反応を担っていたと考えられている。例えば、最も始原的な炭素固定システムの一つである逆カルボン酸回路(rTCA)は、Fe2+によって一部の反応を駆動できる★17。深海熱水の非平衡とチムニー内外の電位差を考慮すると、Fe0- Fe2+という価数が混ざった(Multi-valent)硫化鉄が熱水噴出孔まわりに生じて、rTCAサイクルの一部を駆動できる★18。こちらは、熱水系で常時発生する電気還元力によって継続的な物質生成が可能なプロセスであり、自発的かつ継続的な化学進化が可能とされる。フェレドキシンなどの活性中心に見られる鉄-硫黄クラスターは、生命誕生前から鉄が電子伝達などのさまざまな反応に関与してきた名残であると考えられている★19、20。ドイツの Günter Wächtershäuser博士は、深海熱水噴出孔で硫化鉄などの鉱物が触媒およびエネルギー源となって、原始生命が誕生したと説明した★21〜23。 実際、マッキナワイト(Mackinawite)と硫化水素が反応して黄鉄鉱(Pyrite)と水素が生じる反応は大きなエネルギーを発する。しかしこの反応を直接利した二酸化炭素の還元は未だ実証されていない★24。
また、より生命システムとの関わりを示唆する例として、原始的な独立栄養代謝であるアセチルCoA経路がある。生物学的な系統解析によって、最古の代謝系ではアセチルCoA経路によるエネルギー代謝を実現していたとされるが、二酸化炭素を還元してアセチルCoAを合成するアセチルCoA合成酵素/COデヒドロゲナーゼ(Carbon monoxide dehydrogenase/Acetyl CoA synthase: CODH/ACS)にもFeとNiが含まれており★25、最古の代謝系で既に鉄の恩恵を受けていたことが伺える。窒素に関わる経路でも、鉄が機能している。初期海洋へのアンモニアの供給源は、大気中のN2の酸化によってNOが生成し、それが海に溶け込んだ後に還元されるという経路が提案されているが、Fe2+やFeSが硝酸の還元を担うことができる★26、27。一方生物的には、たとえば根粒菌や超好熱性のメタン菌などの一部の微生物はニトロゲナーゼという酵素を用いて窒素分子(N
ほかにも、たとえば現在の生命はRNAの折りたたみには基本的にMg2+を用いるが、酸素がない環境ではFe2+で同じように折りたたみや触媒活性を維持できることが報告されている★29。RNAの素材となる核酸塩基も、鉄を用いて合成できるようである。鉄を含む鉱物であるヘマタイトやゲーサイトを触媒として、ホルムアミドからアデニン、シトシンを合成した例がある★30。このように、鉄はさまざまなPrebiotic Chemistry (生命前駆化学)を担うとともに、必然的にさまざまな生命システムに取り込まれ、古くから利用されてきたのである。
昔の生命が鉄を使っていたより直接的な証拠も見つかってきた。ハインリッヒハイネ大学のMadeline C. Weiss博士らが最終普遍共通祖先(Last Universal Common Ancestor; LUCA=すべての生命の最後の共通祖先とされる)に起源をもつタンパク質を探索したところ、355個のタンパク質群がみつかった★31、32。これらのタンパク質の特性からLUCAが生まれた環境を推測すると、どうやらLUCAは酸素がほぼない嫌気的な高温環境を好み、二酸化炭素や窒素を生体関連分子に変換して生きる独立栄養生物であったようである。この独立栄養代謝にはFeが必須であったこともわかった。つまり現存する生命は、その最後の共通祖先の時点で既に鉄の恩恵を授かっていたようである。さらに、ラトガース大学のRaanan博士らがタンパク質の3次元トポロジーは1次元配列よりもゆっくりと進化することに注目し、酸化還元酵素スーパーファミリー(Enzyme Classification EC1)の補酵素の結合フォールド☆2の類似性を調べてみると、共通の祖先から進化してきたことがわかった★33。フェレドキシンおよびロスマンフォールドと呼ばれるこの小さな折りたたみ構造は鉄と硫黄でできた電線であるFe-Sクラスターの構成を担っており、生命が最初期の段階から鉄を用いた生命システムを構築していたことを示唆している。現存する生命が用いる電子伝達系の中で、Fe-Sタンパク質は低い還元電位での反応を担うが★34、35、これは生命が誕生した原始海水の還元的な電位に相当する。生命の黎明期から鉄を用いた代謝システムは脈々と受け継がれ、生命システムの至るところで便利な鉄が使われるように進化してきたのである。
地球表層環境は、原始的な還元状態から徐々に酸化的に遷移した。環境の移り変わりに適応するように、Feが生命の進化を促した。25-27億年前にシアノバクテリアが誕生すると、地球表層に酸素がもたらされ、海洋中のFe2+は酸化されて赤いFe3+を含む酸化物の沈殿をつくった(縞状鉄鉱床として、現在でもみられる)。これはすなわち、海洋中で利用できる遊離鉄が大幅に減少したことを示している。環境から吸収した基質の変換に関わる中間代謝は、鉄と酸素を用いた中心代謝の出現により従来の発酵代謝(例えば、酵母菌によるピルビン酸の脱炭酸により生成するアルデヒドからエタノールへの還元反応など)の約20倍まで効率化され(いわゆる、基質的リン酸化から酸化的リン酸化への進化)、この代謝システムを用いる生命の繁栄をもたらした。
このような代謝システムの誕生は地球における生命の多様性を飛躍させ、やがて真核生物が誕生した。酸素をうまく利用して飛躍的な進化を遂げた真核生物はRNAやDNAなどの遺伝情報を核膜で保護している。またエネルギー効率の良い鉄と酸素を用いたシステムは、生命の大型化につながったとされるが、同時に鉄利用の副産物である酸化ストレスとの戦いが始まった。ときには、鉄はフェントン反応 (Fe2+ + H2O2 → Fe3+ + OH- + OH•)を引き起こし、ヒドロキシラジカル(OH•:いわゆる活性酸素)を生じる★36。ヒドロキシラジカルは反応性が高く、強力な酸化剤として働き、これを酸化ストレスという。ヒトにとっては、酸化ストレスは老化や生活習慣病と深く関わっているとされる。生命は、酸素をうまく利用するのに鉄が必要であるが、同時に、鉄利用の副作用である酸化ストレスと上手く付き合っていかなければならない。
■本章のまとめ
■生命が誕生する前、海水中の遊離二価鉄や熱水噴出孔付近で沈殿した硫化鉄が、生命前駆物質の合成に関わっていたようである。
■最終普遍共通祖先の時点で、生命はすでに鉄を利用しており、証拠も見つかってきた。現在では、Fe-Sタンパク質による電子伝達を始めとして、生命システムの至るところで鉄が使われている。
極限環境に生きる生物と鉄はどのような関係を持っているのか
酸素がなくても鉄があれば生きられる生物がいる。Geobacter属細菌などの鉄還元菌は、酸素がない環境で鉄を電子受容体として生命活動を維持する。Geo-は地質を表し、鉄還元菌の代謝を介した鉄のサイクルは地球化学的にも重要である。同じく、嫌気条件下におけるメタンと窒素の循環は生物学的にも地質学的にも重要であるが、鉄の酸化還元と組み合わせることで炭素/窒素の利用を可能にしているようである。ちなみに鉄代謝の歴史は古く、酸素が地球大気の主成分となる27億年前よりも以前のまだ地球表層が還元的な環境であったときから、鉄を電子受容体とする呼吸形式が用いられていたと考えられている★37。硫酸還元菌は、生息環境の硫酸イオン(SO42-)を亜硫酸イオン(SO32-)に変換し (最終的には硫化物イオンまで還元する)、その時生じる酸素原子を有機物に受け渡し二酸化炭素に酸化することでエネルギーを得ている。基質である硫酸イオンは当然減っていき、やがて底をついてしまう。そこで、水中に存在する3価の鉄イオンが亜硫酸イオンを硫酸イオンに酸化する役割を担う。このとき鉄は還元されFe2+となる。このように、硫酸還元菌は鉄を上手く利用して代謝をまわしている。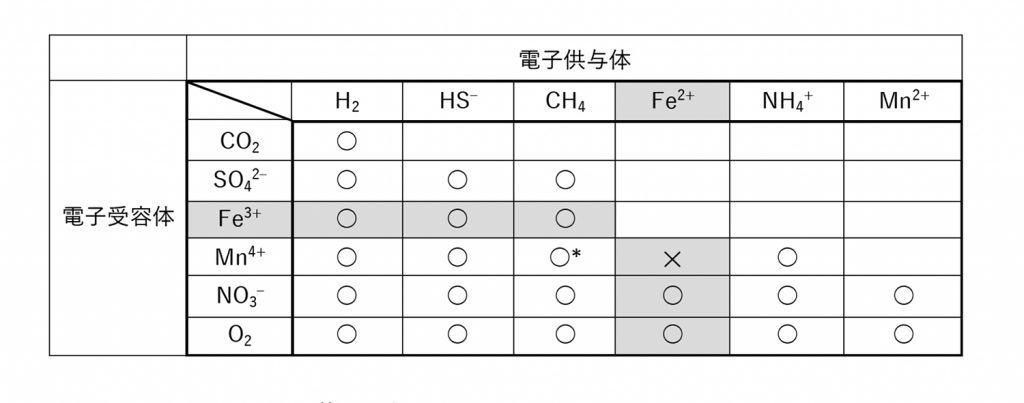
表3──これまでに報告された嫌気性微生物代謝の電子供与体/電子受容体の組み合わせ
一部の微生物やイネ科の植物、海洋性植物プランクトンなどが、一風変わったメカニズムで鉄を利用する。シデロフォアは一部の微生物やイネ科の植物分泌するFe3+と親和性が高いキレート物質であり、Fe3+と熱力学的に安定な八面体型錯体を形成する★40、41。細胞内のFe2+濃度が十分に高いときはFe2+-依存性リプレッサーがシデロフォア生成に関わる遺伝子の発現を抑制している。しかし細胞内のFe2+が欠乏すると、Fe2+をリプレッサーから取り外すことで細胞内の鉄を補い、さらにシデロフォアの分泌が始まり環境中からの鉄の獲得能力が上昇する★42。鉄が欠乏すると生命活動の維持が困難になることから、このような制御機構を用いて細胞内の鉄濃度を維持している。土壌には鉄が豊富なはずなのに植物がこのような機構を備えているのは、土壌のpHが高く鉄が水酸化物として不溶化しているためである。極限環境に生息する生物でもシデロフォアを用いた鉄濃度の制御機構の存在が確認されているが、ゲノム研究に基づくものが多く、化学構造や極限環境における微生物の生存や金属循環における役割の解明にはさらに詳細な研究が必要であると指摘されている★43。
最後に、微生物以外の極限環境に生きる鉄を使う生命について紹介する。スケーリーフットは、インド洋中央海嶺の熱水活動域に生息する腹足類で、硫化鉄の結晶を鱗に保持していることがわかっている(図4)。国立研究開発法人海洋研究開発機構の岡田博士がFIB-SEMを用いてスケーリーフットの鱗を詳細に解析してみたところ、鱗の内部に存在する硫化鉄は、スケーリーフットが鱗内部に半自発的に硫黄を継続的に供給し、海水から浸透してきた鉄と反応するという機構で生じることがわかった★44。これは、共生菌である硫黄酸化細菌によって代謝された後の硫化物を環境中の鉄を用いて排出するメカニズムの一端であり、深海で生きる生物が極限環境に適応するうえで獲得した自発的鉱物形成 (バイオミネラリゼーション)による自浄作用であると考えられ、極限環境に生きる生命の鉄を用いた特殊な生存戦略として注目されている。

図4──硫化鉄を身にまとうスケーリーフット (提供:Chong CHEN博士)
地球において、鉄は4番目に多く存在する元素である。微生物からスケーリーフットなどの深海生物、植物、われわれヒトといった地球で生きる生命は、鉄に依存した生命システムを構築している。地球は水の惑星と呼ばれるが、同時に鉄の惑星でもある。鉄を利用して生命は誕生し、進化してきた。今や鉄は身の回りにありふれた金属であると同時に、生命システムに欠かせない元素なのである。60kgの人間にたった3.6g含まれる鉄が、酸化還元反応を含むさまざまな代謝反応を担っている。生命が鉄を使い始めてから約40 億年、生命は鉄をうまく利用することで地球環境の変化に対応してきた。今後も地球の変化は続くが、その時私たち生命はどのように進化し、鉄はどのように使われるのだろうか。「鉄と生命」の関わりが今後どのように展開されていくのかは、現存する生命の詳細な鉄代謝や極限環境生物の鉄を用いた環境適応に関する研究を進めることで、手がかりが掴めるかもしれない。
■本章のまとめ
■鉄代謝でいえば、鉄還元-水素酸化 (資化) 、硫化水素酸化、メタン酸化、鉄酸化-硝酸還元, 酸素還元の組み合わせがこれまで報告されている。
■現存する生命の詳細な鉄代謝や極限環境生物の鉄を用いた環境適応に関する研究を進めることで、「鉄と生命」の関わりが今後どのように展開されていくのかの手がかりが掴めるかもしれない。
謝辞
本文の執筆あたり粗稿の段階から貴重なコメントをいただき、お力添えいただいた国立研究開発法人海洋研究開発機構の高井研氏、Chong CHEN氏に深く感謝いたします。
注
☆1──元素のブロックのひとつ。dブロックに含まれる元素の物性は、d軌道にどのように電子が配置されるかによって決まる。
☆2──酵素などのタンパク質は多数のアミノ酸が連結したペプチドであるが、このポリペプチド鎖が機能を持った立体構造へ折りたたまれる過程をフォールディングという。
参考文献
★1──R. M. Gordon, J. H. Martin, G. A. Knauer, Iron in north-east Pacific waters. Nature. 299, pp.611–612 (1982).
★2──J. H. Martin, Glacial-interglacial CO2 change: The Iron Hypothesis. Paleoceanography. 5, pp.1–13 (1990).
★3──J. H. Martin, S. E. Fitzwater, Iron deficiency limits phytoplankton growth in the north-east Pacific subarctic. Nature. 331, pp.341–343 (1988).
★4──J. H. Martin, R. M. Gordon, S. Fitzwater, W. W. Broenkow, Vertex: phytoplankton/iron studies in the Gulf of Alaska. Deep Sea Research Part A. Oceanographic Research Papers. 36, pp.649–680 (1989).
★5──J. H. Martin, K. H. Coale, K. S. Johnson, S. E. Fitzwater, R. M. Gordon, S. J. Tanner, C. N. Hunter, V. A. Elrod, J. L. Nowicki, T. L. Coley, R. T. Barber, S. Lindley, A. J. Watson, K. van Scoy, C. S. Law, M. I. Liddicoat, R. Ling, T. Stanton, J. Stockel, C. Collins, A. Anderson, R. Bidigare, M. Ondrusek, M. Latasa, F. J. Millero, K. Lee, W. Yao, J. Z. Zhang, G. Friederich, C. Sakamoto, F. Chavez, K. Buck, Z. Kolber, R. Greene, P. Falkowski, S. W. Chisholm, F. Hoge, R. Swift, J. Yungel, S. Turner, P. Nightingale, A. Hatton, P. Liss, N. W. Tindale, Testing the iron hypothesis in ecosystems of the equatorial Pacific Ocean. Nature. 371, pp.123–129 (1994).
★6──A. Tsuda, S. Takeda, H. Saito, J. Nishioka, Y. Nojiri, I. Kudo, H. Kiyosawa, A. Shiomoto, K. Imai, T. Ono, A. Shimamoto, D. Tsumune, T. Yoshimura, T. Aono, A. Hinuma, M. Kinugasa, K. Suzuki, Y. Sohrin, Y. Noiri, H. Tani, Y. Deguchi, N. Tsurushima, H. Ogawa, K. Fukami, K. Kuma, T. Saino, A Mesoscale Iron Enrichment in the Western Subarctic Pacific Induces a Large Centric Diatom Bloom. Science. 300, pp.958–961 (2003).
★7──A. Tsuda, S. Takeda, H. Saito, J. Nishioka, I. Kudo, Y. Nojiri, K. Suzuki, M. Uematsu, M. L. Wells, D. Tsumune, T. Yoshimura, T. Aono, T. Aramaki, W. P. Cochlan, M. Hayakawa, K. Imai, T. Isada, Y. Iwamoto, W. K. Johnson, S. Kameyama, S. Kato, H. Kiyosawa, Y. Kondo, M. Levasseur, R. J. Machida, I. Nagao, F. Nakagawa, T. Nakanishi, S. Nakatsuka, A. Narita, Y. Noiri, H. Obata, H. Ogawa, K. Oguma, T. Ono, T. Sakuragi, M. Sasakawa, M. Sato, A. Shimamoto, H. Takata, C. G. Trick, Y. W. Watanabe, C. S. Wong, N. Yoshie, Evidence for the grazing hypothesis: Grazing reduces phytoplankton responses of the HNLC ecosystem to iron enrichment in the western subarctic pacific (SEEDS II). Journal of Oceanography. 63, pp.983–994 (2007).
★8──R. J. P. Williams, J. J. R. Fraústo da Silva, in The Chemistry of Evolution, R. J. P. Williams, J. J. R. Fraústo da Silva, Eds. (Elsevier Science Ltd, Amsterdam, 2006), pp.1–34.
★9──P. Nordlund, P. Reichard, Ribonucleotide Reductases. Annual Review of Biochemistry. 75, 681–706 (2006).
★10──M. del M. Cendra, A. Juárez, E. Torrents, Biofilm modifies expression of ribonucleotide reductase genes in Escherichia coli. PloS one. 7, e46350 (2012).
★11──A. I. Oparin, A. E. Braunshtein, A. G. Pysynskii, T. E. Pyvlovskaya, in Pergamon (1959).
★12──S. L. Miller, A Production of Amino Acids Under Possible Primitive Earth Conditions. Science. 117, pp.528–529 (1953).
★13──M. Eigen, Selforganization of matter and the evolution of biological macromolecules. Naturwissenschaften. 58, pp.465–523 (1971).
★14──I. Halevy, A. Bachan, The geologic history of seawater pH. Science. 355, pp.1069–1071 (2017).
★15──H. Ueda, T. Shibuya, Composition of the Primordial Ocean Just after Its Formation: Constraints from the Reactions between the Primitive Crust and a Strongly Acidic, CO2-Rich Fluid at Elevated Temperatures and Pressures. Minerals. 11 (2021).
★16──A. M. Mloszewska, E. Pecoits, N. L. Cates, S. J. Mojzsis, J. O’Neil, L. J. Robbins, K. O. Konhauser, The composition of Earth’s oldest iron formations: The Nuvvuagittuq Supracrustal Belt (Québec, Canada). Earth and Planetary Science Letters. 317–318, pp.331–342 (2012).
★17──K. B. Muchowska, S. J. Varma, J. Moran, Synthesis and breakdown of universal metabolic precursors promoted by iron. Nature. 569, pp.104–107 (2019).
★18──N. Kitadai, R. Nakamura, M. Yamamoto, K. Takai, N. Yoshida, Y. Oono, Metals likely promoted protometabolism in early ocean alkaline hydrothermal systems. Science Advances. pp.5 (2019).
★19──R. E. Mielke, K. J. Robinson, L. M. White, S. E. McGlynn, K. McEachern, R. Bhartia, I. Kanik, M. J. Russell, Iron-Sulfide-Bearing Chimneys as Potential Catalytic Energy Traps at Life’s Emergence. Astrobiology. 11, pp.933–950 (2011).
★20──L. M. White, R. Bhartia, G. D. Stucky, I. Kanik, M. J. Russell, Mackinawite and greigite in ancient alkaline hydrothermal chimneys: Identifying potential key catalysts for emergent life. Earth and Planetary Science Letters. 430, 105–114 (2015).
★21──G. Wächtershäuser, Before enzymes and templates: theory of surface metabolism. Microbiological reviews. 52, pp.452–484 (1988).
★22──G. Wächtershäuser, The case for the chemoautotrophic origin of life in an iron-sulfur world. Origins of life and evolution of the biosphere. 20, 173–176 (1990).
★23──G. Wächtershäuser, On the Chemistry and Evolution of the Pioneer Organism. Chemistry & Biodiversity. 4, pp.584–602 (2007).
★24──E. Drobner, H. Huber, G. Wächtershäuser, D. Rose, K. O. Stetter, Pyrite formation linked with hydrogen evolution under anaerobic conditions. Nature. 346, pp.742–744 (1990).
★25──C. Huber, G. Wächtershäuser, Activated Acetic Acid by Carbon Fixation on (Fe,Ni)S Under Primordial Conditions. Science. 276, pp.245–247 (1997).
★26──D. P. Summers, S. Chang, Prebiotic ammonia from reduction of nitrite by iron (II) on the early Earth. Nature. 365, 630–633 (1993).
★27──D. P. Summers, R. C. B. Basa, B. Khare, D. Rodoni, Abiotic Nitrogen Fixation on Terrestrial Planets: Reduction of NO to Ammonia by FeS. Astrobiology. pp.12, pp.107–114 (2012).
★28──M. Nishizawa, J. Miyazaki, A. Makabe, K. Koba, K. Takai, Physiological and isotopic characteristics of nitrogen fixation by hyperthermophilic methanogens: Key insights into nitrogen anabolism of the microbial communities in Archean hydrothermal systems. Geochimica et Cosmochimica Acta. 138, pp.117–135 (2014).
★29──S. S. Athavale, A. S. Petrov, C. Hsiao, D. Watkins, C. D. Prickett, J. J. Gossett, L. Lie, J. C. Bowman, E. O’Neill, C. R. Bernier, N. v Hud, R. M. Wartell, S. C. Harvey, L. D. Williams, RNA Folding and Catalysis Mediated by Iron (II). PLOS ONE. 7, 1–7 (2012).
★30──U. Shanker, B. Bhushan, G. Bhattacharjee, Kamaluddin, Formation of Nucleobases from Formamide in the Presence of Iron Oxides: Implication in Chemical Evolution and Origin of Life. Astrobiology. 11, pp.225–233 (2011).
★31──M. C. Weiss, F. L. Sousa, N. Mrnjavac, S. Neukirchen, M. Roettger, S. Nelson-Sathi, W. F. Martin, The physiology and habitat of the last universal common ancestor. Nature Microbiology. 1, pp.16116 (2016).
★32──M. C. Weiss, M. Preiner, J. C. Xavier, V. Zimorski, W. F. Martin, The last universal common ancestor between ancient Earth chemistry and the onset of genetics. PLOS Genetics. 14, 1–19 (2018).
★33──H. Raanan, S. Poudel, D. H. Pike, V. Nanda, P. G. Falkowski, Small protein folds at the root of an ancient metabolic network. Proceedings of the National Academy of Sciences. 117, pp.7193–7199 (2020).
★34──D. O. Hall, R. Cammack, K. K. Rao, Role for Ferredoxins in the Origin of Life and Biological Evolution. Nature. 233, pp.136–138 (1971).
★35──A. C. Mutter, A. M. Tyryshkin, I. J. Campbell, S. Poudel, G. N. Bennett, J. J. Silberg, V. Nanda, P. G. Falkowski, De novo design of symmetric ferredoxins that shuttle electrons in vivo. Proceedings of the National Academy of Sciences. 116, pp.14557–14562 (2019).
★36──J. Prousek, Fenton chemistry in biology and medicine. Pure and Applied Chemistry. 79, pp.2325–2338 (2007).
★37──M. Vargas, K. Kashefi, E. L. Blunt-Harris, D. R. Lovley, Microbiological evidence for Fe(III) reduction on early Earth. Nature. 395, pp.65–67 (1998).
★38──A. A. Raghoebarsing, A. Pol, K. T. van de Pas-Schoonen, A. J. P. Smolders, K. F. Ettwig, W. I. C. Rijpstra, S. Schouten, J. S. S. Damsté, H. J. M. Op den Camp, M. S. M. Jetten, M. Strous, A microbial consortium couples anaerobic methane oxidation to denitrification. Nature. 440, pp.918–921 (2006).
★39──A. O. Leu, C. Cai, S. J. McIlroy, G. Southam, V. J. Orphan, Z. Yuan, S. Hu, G. W. Tyson, Anaerobic methane oxidation coupled to manganese reduction by members of the Methanoperedenaceae. The ISME Journal. 14, pp.1030–1041 (2020).
★40──S. M. Kraemer, A. Butler, P. Borer, J. Cervini-Silva, Siderophores and the Dissolution of Iron-Bearing Minerals in Marine Systems. Reviews in Mineralogy and Geochemistry. 59, pp.53–84 (2005).
★41──P. M. Borer, B. Sulzberger, P. Reichard, S. M. Kraemer, Effect of siderophores on the light-induced dissolution of colloidal iron(III) (hydr)oxides. Marine Chemistry. 93, pp.179–193 (2005).
★42──M. Miethke, M. A. Marahiel, Siderophore-Based Iron Acquisition and Pathogen Control. Microbiology and Molecular Biology Reviews. 71, pp.413–451 (2007).
★43──L. O. de Serrano, A. K. Camper, A. M. Richards, An overview of siderophores for iron acquisition in microorganisms living in the extreme. Biometals : an international journal on the role of metal ions in biology, biochemistry, and medicine. 29, pp.551–571 (2016).
★44──S. Okada, C. Chen, T. Watsuji, M. Nishizawa, Y. Suzuki, Y. Sano, D. Bissessur, S. Deguchi, K. Takai, The making of natural iron sulfide nanoparticles in a hot vent snail. Proceedings of the National Academy of Sciences. 116, pp.20376–20381 (2019).
たかはぎ・わたる
1993年生まれ。東京大学大学院理学系研究科博士課程、国立研究開発法人海洋研究開発機構臨時研究補助員。化学・アストロバイオロジー専門。慶應義塾大学環境情報学部卒業、同修士課程政策・メディア研究科修了(Certificate of Systems Biology)。土星の衛星エンセラダスにおける生命発生の可能性を検討し、研究成果を2019年に国際誌ACS Earth and Space Chemistryにて発表。現在は深海熱水噴出孔環境における局所的な物質濃集の可能性を中心に生命起源の謎に挑む。
きただい・のりお
1983年 徳島県生まれ。海洋研究開発機構 超先鋭研究開発部門 超先鋭研究プログラム 副主任研究員。大阪大学大学院理学研究科博士後期課程修了、博士(理学)。深海熱水噴出孔環境の発電現象に着目した生命起源研究を展開し、最近はScience Advances、Communications Chemistry誌などにて研究成果を発表。2018年度日本地球化学会奨励賞受賞。
- 3号の読み方:鉄はいつでもそこにある
-
How to read No. 3: Iron is always there
/阅读指南:从未缺席的铁
伊藤孝/Takashi Ito - インタビュー:アナトリア──文明と鉄の関係の幕開け
-
Anatolia and the Origins of the Relationship between Iron and Civilization: An Interview with Sachihiro Omura
/访谈:安纳托利亚——文明与铁关系的拂晓
大村幸弘/Sachihiro Omura - 鉄と生命──鉄はなぜ生命に選ばれたのか
-
Role of Iron in Life: A Review
/铁与生命——铁为什么选择了生命
高萩航+北台紀夫/Wataru Takahagi+Norio Kitadai - 鋼の構築様式
-
Steel and the Origin of Building Mode 3
/钢铁的构筑方式
中谷礼仁(文)+松田法子(図)/Norihito Nakatani+Noriko Matsuda - 鉄に依存した赤血球による酸素輸送と人工赤血球
-
Iron-Dependent Oxygen Transport by Red Blood Cells and Artificial Red Blood Cells
/依赖于铁的红细胞运氧和人工红细胞
酒井宏水/Hiromi Sakai - インタビュー:鉄・生命・メタ生物圏
-
Interview: Iron, Life, and the Metabiosphere
/采访:铁・生命・元生物圈
長沼毅/Takeshi Naganuma
協賛/SUPPORT サントリー文化財団(2020年度)、一般財団法人窓研究所 WINDOW RESEARCH INSTITUTE(2019〜2021年度)、公益財団法人ユニオン造形財団(2022年度〜)



